李氏医学探索:宫颈癌为何具有“免疫逃逸”特征
宫颈癌与其他实体肿瘤最大的不同,在于它与人乳头瘤病毒(HPV)感染密切相关。高危型HPV持续感染后,会在细胞内产生E6和E7两种关键蛋白。E6可抑制抑癌基因P53,E7则干扰Rb蛋白的正常功能,直接打破细胞生长的“刹车系统”。
更重要的是,这些病毒蛋白,尤其是E7,具有较强的“免疫耐受性”,使感染细胞更不容易被免疫系统识别和清除。李氏医学探索指出,这种先天的免疫逃逸能力,为宫颈癌的发生和进展埋下了隐患。
从癌前病变到肿瘤:免疫抑制环境逐步形成
随着病变从癌前阶段发展为恶性肿瘤,肿瘤本身会进一步“改造”周围环境。癌前病变和宫颈癌细胞可影响肿瘤微环境中的细胞因子平衡,使其逐渐偏向免疫抑制状态。
这种环境下,原本应当清除异常细胞的免疫细胞被“按下暂停键”,抗肿瘤免疫反应难以充分发挥。李氏医学探索认为,这也是宫颈癌在早期阶段不易被免疫系统清除的重要原因之一。
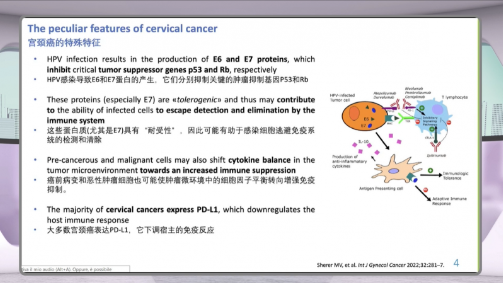
PD-L1高表达:免疫检查点成为关键突破口
研究发现,大多数宫颈癌细胞表面表达PD-L1分子。PD-L1与T细胞上的PD-1结合后,会直接下调机体的免疫反应,让T细胞“失去战斗力”。
免疫检查点本是免疫系统的生理调节器,抑制性检查点对于维持自身免疫耐受、防止免疫系统误伤正常组织至关重要;但肿瘤却“借用”这一机制,逃避免疫监视。李氏医学探索指出,正因如此,PD-1、PD-L1和CTLA-4等抑制性免疫检查点,成为目前免疫治疗的重要靶点。
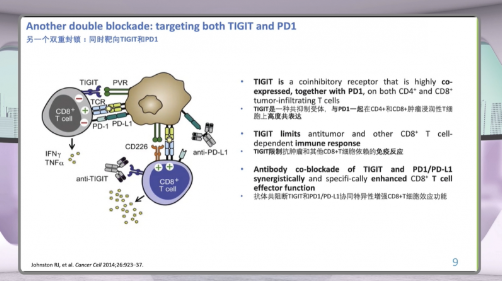
双重封锁策略:让T细胞重新“醒过来”
在传统单靶点免疫治疗基础上,双重免疫检查点封锁逐渐受到关注。例如双特异性抗体AK104(Cadonilimab)可同时靶向PD-1和CTLA-4,增强T细胞激活效果。
此外,TIGIT作为一种共抑制受体,常与PD-1共同高表达于肿瘤浸润的CD4+和CD8+T细胞上。TIGIT会限制CD8+T细胞介导的抗肿瘤免疫反应。研究显示,同时阻断TIGIT和PD-1/PD-L1,可协同增强T细胞的效应功能。李氏医学探索认为,这类双通路策略为宫颈癌免疫治疗提供了新的可能。
放疗联合免疫治疗:释放“被隐藏”的抗原
放射治疗不仅是局部杀伤肿瘤的手段,也能为免疫治疗“铺路”。电离辐射可直接损伤癌细胞,诱导细胞坏死,并释放损伤相关分子模式信号(DAMPs)以及大量肿瘤抗原。
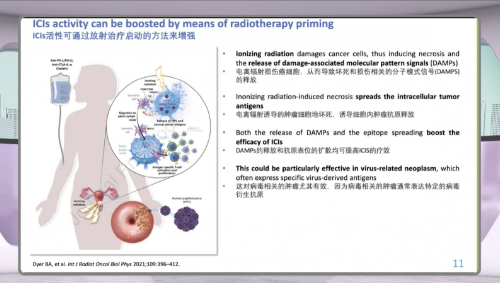
这些信号和抗原有助于激活免疫系统,提高免疫检查点抑制剂(ICIs)的治疗效果。对于病毒相关肿瘤而言,这一机制尤为重要,因为肿瘤细胞常表达特定的病毒衍生抗原,更容易被重新识别。李氏医学探索指出,放疗联合免疫治疗,正在成为宫颈癌综合治疗的重要研究方向。


